ملح الطعام (كلوريد الصوديوم)
ملح الطعام يتكون الملح المعروف بشكل رئيسي من مركب كيميائي يعرف بكلوريد الصوديوم( NaCl) والذي ينتمي لمجموعة أكبر من الأملاح. يوجد ملح الطعام في الطبيعية على هيئة بلّورات معدنية تُعرف بالملح الصخري أو الهاليت. يوجد ملح الطعام بكثرة في ماء البحار حيث هو المُكَوِّن المعدني الرَّئيسي فيه. يحتوي المحيط على قرابة 35 جرام من الملح لكل لتر (oz 1.2) وملوحة 3.5%. يُعدُّ الملح ضروريًّا لحياة الحيوان، ويتواجد في أنسجة الحيوانات أكثر من أنسجة النبّاتات. لذلك فإن نمط غذاء البدو المعتاد الذين يعيشون على قطعانهم لايُحتاج فيه إلى الملح أو يُضاف بكميَّاتٍ قليلة، بينما نظام الغذاء المعتمد على القمح يحتاج إلى مكمّلات غذائية. وتعد الملوحة أحد أساسيّات حاسَّة التذوق لدى الإنسان. كما أن الملح من أقدم وأوفر التوابل، ويعد التمليح من أهم طرق حفظ الأطعمة.
يركب الملح بشكل أساسي من المركب الأيوني كلوريد الصوديوم ذي الصيغة الكيميائية NaCl والذي يحتوي نسب متساوية من الصوديوم والكلور.. ويحتوي ملح البحر والملح المستخرج من المناجم (غالبا ما يكون مصدره ماء البحر من بحار عصر ما قبل التاريخ) على العناصر الزهيدة (والمفيدة بكميات قليلة لبعض الحيوانات والنباتات). تتم معالجة الملح المستخرج من المناجم (الملح المعدني) واستخدامه في إنتاج ملح الطعام (ملح الطاولة) عن طريق إذابته في الماء وتنقيته من خلال ترسيب باقي المعادن وإخراجها من المحلول ثم إعادة تبخيره. وغالبا ما يضاف اليود بعد هذه المعالجة. إن بلورات الملح شافَّة (شبه شفافة) غالبا ومكعبة الشكل، وتبدو بيضاء بالغالب لكن قد تعطيها بعض الشوائب لونا أزرق أو أرجواني. تساوي الكتلة المولية للملح 58.443 جم\مول، ودرجة ذوبانه تساوي 801°م وتساوي درجة غليانه 1465°م. كما تساوي كثافته 2017 جم\سم3. يُعد الملح سريع الذوبان في الماء ومعدل ذائبيته تساوي 359 جم\لتر، وعندما يُذاب الملح فيه فإنه ينفصل إلى أيون الصوديوم +Na وأيون الكلوريد - Cl. إن تبلور محلول الماء والملح يُنتج ثنائي الهيدرات NaCl•2H2O. كما أن محاليل كلوريد الصوديوم مع الماء لها خصائص مختلفة عن المياه النقية; حيث تنخفض درجة التجمد إلى -21.12 °م عند كون كتلة الملح 23.31% من المحلول، ودرجة الذوبان لمحلول ملح مشبع تساوي تقريبا 108.7°م.
البوتاس (هيدروكسيد البوتاسيوم)
هيدروكسيد البوتاسيوم (KOH) أوالبوتاس الكاوي هو مركب كيميائي شديد القاعدية.
هيدروكسيد البوتاسيوم شديد الذوبانيه بالماء ومع طرد كميه من الحراره ويتميز انه من القلويات ويأخذ شكل اقراص بيضاء او قشور لا تتحمل درجه الحراره وظهور لون بنفسجي كما ان سعر هيدروكسيد البوتاسيوم مرتفع فا يفضل الاستخدام هيدروكسيد الصوديوم في الصناعه لانه رخيص جدا
من أقدم الطرق المستخدمة لتحضير هيدروكسيد البوتاسيوم الطريقة التي تعتمد على غلي محلول من كربونات البوتاسيوم مع هيدروكسيد الكالسيوم (الجير المطفأ)، حيث يحدث تفاعل استبدال ينتج عنه ترسب كربونات الكالسيوم تاركاً هيدروكسيد البوتاسيوم في المحلول.
Ca(OH)2 (s), (aq) + K2CO3 (aq) → CaCO3 (s) + 2KOH (aq)
بترشيح كربونات الكالسيوم المترسبة وغلي المحلول مرة أخرى نحصل على محلول البوتاس الكاوي.
الاستخدامات
يستخدم في الزراعة لاستصلاح درجة قاعدية الأراضي (البور) الحامضية. كما يمكن استخدامه كمبيد للأعشاب والفطريات. ويستخدم في اضافته إلى البطاريات
يستخدم في صناعة الصابون و الورق وكذلك ايضأ يستخدم لتشخيص الإصابة بالبكتيريا المهبليه والفطريات المهبلية للنساء
الجير الحي ( اكسيد الكالسيوم)
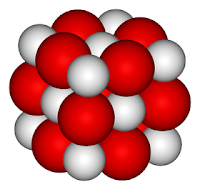 أكسيد الكالسيوم أو الجير الحي مركب كيميائي له الصيغة CaO ، ويكون على شكل مسحوق أبيض عديم الشكل البلوري (غير متبلور) في الحالة العادية، لكن ببلورته من مصهوره نحصل على بلورات مكعبية الشكل لها نمط بلورات كلوريد الصوديوم.
أكسيد الكالسيوم أو الجير الحي مركب كيميائي له الصيغة CaO ، ويكون على شكل مسحوق أبيض عديم الشكل البلوري (غير متبلور) في الحالة العادية، لكن ببلورته من مصهوره نحصل على بلورات مكعبية الشكل لها نمط بلورات كلوريد الصوديوم.يتفاعل لدى تماسه مع الماء (تفاعل حلمهة) بشكل ناشر للحرارة مشكلاً هيدروكسيد الكالسيوم (الكلس المطفأ).
يحضر أكسيد الكالسيوم صناعياً من تسخين كربونات الكالسيوم إلى حوالي 900°س (التفكك الحراري للحجر الجيري).
CaCO3 → CaO + CO2
يمكن تحضير أكسيد الكالسيوم مخبرياً من أكسدة فلز الكالسيوم
الاستخدامات
يستعمل في تحضير هيدروكسيد الكالسيوم المستخدم في مواد البناء.
يستعمل كمادة قلوية في علم التعدين وفي صناعة الزجاج.
نتيجة ارتفاع درجة انصهاره يستخدم أكسيد الكالسيوم لتبطين الأفران.
بيكنج صودا (بيكربونات الصوديوم)
بيكربونات الصوديوم أو كربونات الصوديوم الحامضية هو مركب كيميائي له الصيغة NaHCO3. تعرف أيضا بـ صودا الخَبْز.
 بيكربونات الصوديوم مسحوق بلوري أبيض، قابل للانحلال بالماء، وغير منحل في الكحول، وعندما يتم تسخينه في الأوساط الجافة أو في السوائل فإنه يتحول تدريجياً إلى كربونات الصوديوم.
بيكربونات الصوديوم مسحوق بلوري أبيض، قابل للانحلال بالماء، وغير منحل في الكحول، وعندما يتم تسخينه في الأوساط الجافة أو في السوائل فإنه يتحول تدريجياً إلى كربونات الصوديوم.تكون بيكربونات الصوديوم ثابتة في الهواء الجاف، لكنها تتفكك ببطء في الهواء الرطب، لذلك يجب حفظها في عبوات محكمة الإغلاق، في أماكن باردة وجافة.
يستخدم بشكل واسع في الصناعات الغذائية، ويستخدم في إنضاج العجين حيث يتحرر غاز ثاني أكسيد الكربون فينتفخ العجين.
يستخدم في التخلص من الروائح الكريهة
يستخدم كمبيد للنمل
في الصناعات الدوائية كمادة مضادة للحموضة، وللقضاء علي حب الشباب
في العديد من التطبيقات الأخرى مثل طفايات الحريق، الصابون، المنظفات، وكمادة مضافة في علف الحيوانات.
ماء الاكسجين (بروكسيد الهيدروجين)
بيروكسيد الهيدروجين (أو الماء الأكسجيني) مركب كيميائي له الصيغة (H2O2)، وهو ذو لون أزرق باهت والذي يبدو عديم اللون في المحاليل الممدة، وهو بشكل طفيف أكثر لزوجة من الماء. يعد فوق أكسيد الهيدروجين حمضًا ضعيفًا، إلا أنه من المواد المبيضة الجيدة نظرًا لخواصه المؤكسدة القوية.
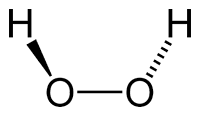 يمكن تفكيك فوق أكسيد الهيدروجين للحصول على الماء والأكسجين بوضع عامل المساعد هو ثاني أكسيد المنجنيز ويعطي أكسجين نقي وفقاً للمعادلة الموزونة التالية :
يمكن تفكيك فوق أكسيد الهيدروجين للحصول على الماء والأكسجين بوضع عامل المساعد هو ثاني أكسيد المنجنيز ويعطي أكسجين نقي وفقاً للمعادلة الموزونة التالية :MnO2 + 2H2O2 → MnO2 + O2 + 2H2O
يباع بيروكسيد الهيدروجين في الصيدليات على شكل مطهر للجروح بتركيز منخفض3% ويباع في محلات ادوات التجميل بنسبة قد تصل إلى 20-25%
المخاطر
ماده بروكسيد الهيدروجين لها خواص مؤكسده قويه جدا لها رائحه حمض النتريك يسبب حروق مؤلمه جدا ذو طعم لاذع متفجر عند التسخين هذه إذا كان درجه تركيزه عاليه بنسبه 40% او30% او اعلي اما إذا كان درجه تركيزه منخفض 7 % لا يحرق لا يسمم مفيد جدا ويباع بالصيدليات اقل من 10%
 الفينول هو مركب صلب بلوري عديم اللون ذو رائحة قاريّة لطيفة، وغالبًا ما يشار إليها برائحة المشافي. صيغته الكيميائية المجملة C6H6O، والتي يمكن أن تكتب بالشكل المفصل C6H5OH. وبنيته عبارة عن زمرة الهيدروكسيل مرتبطة بحلقة فينيل، ف فهو مركب عطري.
الفينول هو مركب صلب بلوري عديم اللون ذو رائحة قاريّة لطيفة، وغالبًا ما يشار إليها برائحة المشافي. صيغته الكيميائية المجملة C6H6O، والتي يمكن أن تكتب بالشكل المفصل C6H5OH. وبنيته عبارة عن زمرة الهيدروكسيل مرتبطة بحلقة فينيل، ف فهو مركب عطري.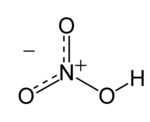 في الكيمياء، ماء النار (باللاتينية: aqua fortis) بمعنى الماء القوي أو الشديد) هو مصطلح كان يستخدم للإشارة إلى حمض النتريك HNO3. كان العالم جابر بن حيان هو أول من وصف تلك المادة، والتي أبدت قدرة على إذابة المعادن المختلفة بما فيها الفضة، ما عدا الذهب، والذي يذاب باستخدام الماء الملكي.
في الكيمياء، ماء النار (باللاتينية: aqua fortis) بمعنى الماء القوي أو الشديد) هو مصطلح كان يستخدم للإشارة إلى حمض النتريك HNO3. كان العالم جابر بن حيان هو أول من وصف تلك المادة، والتي أبدت قدرة على إذابة المعادن المختلفة بما فيها الفضة، ما عدا الذهب، والذي يذاب باستخدام الماء الملكي.




























ليست هناك تعليقات:
إرسال تعليق